作者:杉杉
导读:
近期,新疆大学的Ablimit Abdukader等人在Green Chem.中发表论文,报道一种全新的可见光诱导扁桃酸与醇的氧化酯化反应方法学,进而成功完成一系列α-酮酸酯分子的构建。机理研究表明,该反应涉及自由基的过程。
Visible light-induced oxidative esterification of mandelic acid with alcohols: a new synthesis of α-ketoesters
Z. Mao, K. Xia, K. Zhang, H. Chen, M. Li, A. Abdukader, W. Jin, Green Chem.2024, 26, 6046. doi: 10.1039/D4GC00249K.

正文:
α-酮酸酯骨架广泛存在于各类药物以及生物活性分子中。同时,也是一种极具价值的前体。并且,在过去的几十年里,已经成功设计出多种构建α-酮酸酯分子的合成转化策略[1] (Scheme 1)。然而,此类反应常需使用过量的化学计量氧化剂、金属催化剂以及存在苛刻的条件等。受到近年来对于Lewis金属配合物催化酸与醇的直接酯化反应方法学[2](Scheme 2a)或以及三氟甲磺酸镍催化扁桃酸与醇的酯化反应方法学[3] (Scheme 2b)相关研究报道的启发,这里,新疆大学的Ablimit Abdukader等人报道一种全新的可见光诱导扁桃酸与醇的氧化酯化反应方法学,进而成功完成一系列α-酮酸酯分子的构建(Scheme 2c)。
 首先,作者采用扁桃酸1a与正丁醇2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Eosin Y作为光催化剂, DTBP作为氧化剂,18 W蓝色LEDs(455-460 nm)作为光源,反应温度为室温,最终获得70%收率的产物3aa。
首先,作者采用扁桃酸1a与正丁醇2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Eosin Y作为光催化剂, DTBP作为氧化剂,18 W蓝色LEDs(455-460 nm)作为光源,反应温度为室温,最终获得70%收率的产物3aa。
在上述的最佳反应条件下,作者分别对一系列扁桃酸底物以及醇底物 (Table 2)的应用范围进行深入研究。
Table 2 Substrate scopea

a General conditions: 1 (0.2 mmol), 2 (0.5 mmol), Eosin Y (1 mol%), and DTBP(1 equiv.) stirred at rt (25-30 ℃) with the irradiation of 18 W blue LEDs under air for 48-60 h. Isolated yields. For 3ah and 3gp generated from solid alcohols, DCE (0.5 mL) was added as the solvent.
之后,作者对上述氧化酯化过程的反应机理进行进一步研究 (Schemes 3-5)。




 之后,上述的产物可以被高效地转化为其他砌块(Scheme 6)。
之后,上述的产物可以被高效地转化为其他砌块(Scheme 6)。
 基于上述的实验研究,作者提出如下合理的反应机理 (Scheme 7)。
基于上述的实验研究,作者提出如下合理的反应机理 (Scheme 7)。
总结:
新疆大学的Ablimit Abdukader等人报道一种全新的可见光诱导扁桃酸与醇的氧化酯化反应方法学,进而成功完成一系列α-酮酸酯分子的构建。这一全新的氧化酯化合成转化策略无需使用金属催化剂,具有反应条件温和、操作简单、底物范围广泛以及优良的官能团兼容性等优势。
参考文献:
- [1] C. Zhang, P. Feng, N. Jiao, J. Am. Chem. Soc. 2013, 135, 15257. doi: 10.1021/ja4085463.
- [2] Z. Tang, Q. Jiang, L. Peng, X. Xu, J. Li, R. Qiu, C. Au, Green Chem. 2017, 19, 5396. doi: 10.1039/C7GC02174G.
- [3] C. Liu, M. Marhaba, A. Dilshat, W. Zhu, K. Xia, Z. Mao, A. Ablimit, Arab. J. Chem.2023, 16, 104407. doi:10.1016/j.arabjc.2022.104407.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
本文作者:杉杉
导读
近日,武汉大学雷爱文和陕西师范大学高子伟课题组在Green Chem.发表论文,通过电化学过程,实现了硫氰化烯胺酮(thiocyanatedenaminones)的高度立体选择性合成,涉及C-H键硫氰化(thiocyanation)以及乙烯基C-N键氨基转移(transamination)的过程。同时,各种芳基烯胺酮均与体系相容,以高达87%的收率获得所需的硫氰化烯胺酮化合物。值得注意的是,该反应无需外部氧化剂、电解质和过渡金属催化剂。此外,克级实验进一步证明了反应的实用性。相关成果发表于近期Green Chem.,其中武汉大学雷爱文教授及其课题组成员Lu Lijun和陕西师范大学高子伟教授为共同通讯作者。
Electrochemical oxidative thiocyanation and amination ofenaminones towards the synthesis of multi-substituted alkenes
Fangling Lu, Kan Zhang, Yanxiu Yao, Ying Yin, Jiafu Chen, Xinwei Zhang, Yin Wang, Lijun Lu,Ziwei Gao, Aiwen Lei
Green Chem. ASAP DOI:10.1039/D0GC03590D
正文
有机硫氰酸酯(thiocyanates)作为一类重要的骨架,广泛存在于药物和农用化学品中。此外,有机硫氰酸酯还作为通用的中间体,可用于合成各种具有价值的含硫化合物,如磺酸、硫杂环、硫醇、硫化物等。因此,构建有机硫氰酸酯的方法引起了化学家的广泛关注,如芳基硫醚的传统氰化(cyanation)方法和芳环上的亲核或亲电取代反应 [1]。近年来,涉及过渡金属催化[2]、氧化剂氧化[3]或光氧化还原催化[4]的硫氰化反应已成为合成有机硫氰酸酯更为有效的策略。2019年,Wan课题组[5]报道了可见光诱导烯胺酮的硫氰化。随后,Wu课题组[6]以空气为终端氧化剂,实现了可见光促进被活化酮的氨基硫氰化。最近,Duan课题组[7]使用烯胺酮、KSCN和NBS为底物,实现了溶剂控制的硫氰化反应。然而,此类反应存在一定的局限性,如有限的底物范围、必需的过渡金属催化剂或光催化剂等。
电化学氧化还原反应,作为一种高效且环保的方法。可使用廉价、可再生且本质安全的电子作为无质量试剂进行电合成,以活化有机分子以生成反应性中间体,符合绿色化学的需求。近些年来,电化学C-H硫氰化也取得一定的进展。如2010年,Becker课题组[8]报道了芳族化合物的阳极硫氰化反应,随后,该课题组又实现了烯烃的两步阳极硫氰化法。此外,由于电解质是电解反应的基本元素,而在许多电化学反应中,辅助电解质仅用于导电,在反应后会浪费掉。因此,若能使用可充当电解质的底物,则符合原子经济性的特点。在此,本文将介绍一种在无金属、无外部氧化剂和无外部电解质的条件下,通过电化学阳极氧化从而高效构建硫氰化烯胺酮衍生物的方法。
首先,作者以(E)-3-(二甲基氨基)-1-苯基丙-2-烯-1-酮1a和硫氰酸铵2a作为模型底物,进行了相关反应条件的筛选(Table 1)。反应的最佳条件为:以CH3CN/H2O/HFIP作为混合溶剂,氮气保护下,在无隔膜的电解槽中以18 mA恒定电流持续反应4 h,即可获得84%收率的目标产物3a。
在获得上述最佳反应条件后,作者开始对烯胺酮底物1进行了扩展(Scheme 1)。反应结果表明,苯环上的取代基,不受电子效应和定位效应的影响,均可获得相应的产物3a–3q。值得注意的是,具有卤素取代基的底物(3g–3m),同样与体系兼容,为进一步功能化提供了多种可能。此外,杂环和多环芳烃均以50-75%的收率获得相应的产物3r–3v。然而,对于其它N, N-二取代的烯胺酮在标准反应条件下未能进行反应,如2w和2x。
随后,为了进一步证明反应的实用性,作者进行了克级实验(Scheme 2)。反应结果表明,1a与2a可顺利进行反应,获得62%收率的目标产物3a。
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 3)。当在标准条件下加入1,1-二苯乙烯(DPE)时,仅获得25%收率的硫氰化烯胺酮,同时通过GC-MS检测到DPE-SCN加合物。这些结果表明,反应可能经历了自由基途径,硫氰基自由基中间体可能参与了转化。其次,当使用KSCN代替NH4SCN时,未观察到所需的产物,表明产物的氨基源自NH4SCN。此外,通过对两种标准底物1a和2a的循环伏安(CV)实验表明,在1.59 V处观察到1a的氧化峰,在1.49 V处观察到2a的氧化峰,表明2a在阳极优先被氧化(Scheme 4)。
根据上述的实验和相关文献的查阅[5,6,9],作者提出了一种可能的反应机理(Scheme 5)。首先,SCN–被阳极氧化为硫氰酸自由基,然后快速二聚生成二硫键。然后,将硫氰酸自由基加到C=C双键上,生成中间体INT-1,经单电子阳极氧化,形成阳离子中间体INT-2,再被NH3亲核进攻,从而生成相应的中间体INT-3。最后,中间体INT-3经N,N-二甲基胺和质子的消除,得到所需的产物3a。此外,在阴极处,铵离子可被还原产生氨气和氢气。
总结
武汉大学雷爱文和陕西师范大学高子伟课题组报道了,一种高效且具有高度立体选择性的电化学策略,成功构建硫氰化烯胺酮衍生物。同时,该反应具有广泛的底物范围、良好的官能团耐受性、反应条件温和等特点。值得注意的是,该反应无需使用额外的金属催化剂、外部氧化剂以及电解质(底物NH4SCN可充当)。
参考文献
[1] a) T. Castanheiro, M. Gulea, M. Donnard and J. Suffert, Eur. J. Org. Chem., 2014, 2014, 7814-7817; b) F. Teng, J. T. Yu, H. Yang, Y. Jiang and J. Cheng, Chem. Commun., 2014, 50, 12139-12141. d) R. Frei, T. Courant, M. D. Wodrich and J. Waser, Chemistry, 2015, 21, 2662-2668; d) X.-H.Li, L.-G. Li, X.-L. Mo and D.-L. Mo, Synthetic Commun.,2016, 46, 963-970; e) W. Guo, W. Tan, M. Zhao, L. Zheng, K. Tao, D. Chen and X. Fan, J. Org. Chem., 2018, 83, 6580-6588. [2] a) X.-Z. Zhang, D.-L.Ge, S.-Y.Chen and X.-Q. Yu, RSC Adv., 2016, 6, 66320-66323. b) H. Jiang, W. Yu, X. Tang, J. Li and W. Wu, J. Org. Chem., 2017, 82, 9312-9320; c) Y. Chen, S. Wang, Q. Jiang, C. Cheng, X. Xiao and G. Zhu, J. Org. Chem., 2018, 83, 716-722; d) A. Dey and A. Hajra, Adv. Synth.Catal., 2019, 361, 842-849; e) M. Gao, M. Y. Chen, X. Pannecoucke, P. Jubault and T. Besset, Chem. Eur. J. 2020, 26, 15497-15500. [3] a) J. Wu, G. Wu and L. Wu, Synthetic Commun., 2008, 38, 2367-2373; b) D. Yang, K. Yan, W. Wei, G. Li, S. Lu, C. Zhao, L. Tian and H. Wang, J. Org. Chem., 2015, 80, 11073-11079; c) H. Yang, X. H. Duan, J. F. Zhao and L. N. Guo, T Org. Lett., 2015, 17, 1998-2001. d) X.-Z. Zhang, D.-L.Ge, S.-Y. Chen and X.-Q. Yu, RSC Adv., 2016, 6, 66320-66323. e) T. Kittikool and S. Yotphan, Eur. J. Org. Chem., 2020, 2020, 961-970; f) X. Mao, J. Ni, B. Xu and C. Ding, Org. Chem. Front., 2020, 7, 350-354. [4]a) W. Fan, Q. Yang, F. Xu and P. Li, J. Org. Chem., 2014, 79, 10588-10592; b) S. Mitra, M. Ghosh, S. Mishra and A. Hajra, J. Org. Chem., 2015, 80, 8275-8281. c) P. Chauhan, Ritu, Preeti, S. Kumar and N. Jain, Eur. J. Org. Chem., 2019, 2019, 4334-4340; d) Y.-J. Chen, Y.-H. He and Z. Guan, Tetrahedron, 2019, 75, 3053-3061; e) Y. Chen, Y.-J.Chen, Z. Guan and Y.- H. He, Tetrahedron, 2019, 75, 3053-3061; f) G. Li, Q. Yan, X. Gong, X. Dou and D. Yang, ACS Sustain. Chem. Eng., 2019, 7, 14009-14015. [5] Y. Gao, Y. Liu and J.-P. Wan, J. Org. Chem., 2019, 84, 2243-2251. [6] P.-F. Yuan, Q.-B.Zhang, X.-L.Jin, W.-L.Lei, L.-Z.Wu and Q. Liu, Green Chem., 2018, 20, 5464-5468. [7] X. Duan, X. Liu, X. Cuan, L. Wang, K. Liu, H. Zhou, X. Chen, H. Li and J. Wang, J. Org. Chem., 2019, 84, 12366-12376. [8] A. Gitkis and J. Y. Becker, A ElectrochimicaActa, 2010, 55, 5854-5859; c) A. Gitkis and J. Y. Becker, Electroanalysis, 2016, 28, 2802-2807; [9]. Z. Yang, Y. Wang, L. Hu, J. Yu, A. Li, L. Li, T. Yang and C. Zhou, Synthesis, 2019, 52, 711-718.6月24日-6月29日,第十三届氧气活化和均相氧化催化国际研讨会(The 13th International Symposium on Activation of Dioxygen and Homogeneous Oxidation Catalysis, ADHOC 2018, Xi’an, China)在中国・西安・陕西师范大学长安校区新勇学生活动中心召开。本次会议由国家自然科学基金委员会主办,北京大学、武汉大学和陕西师范大学承办。
这是ADHOC研讨会首次在中国召开,来自美国、俄罗斯、意大利、法国、英国、德国、日本、西班牙、韩国、印度、新加坡等多个国家,以及国内各地知名高校及研究机构的的著名科学家、优秀中青年学者、学生代表,200多位海内外学者共同相聚在西安这一世界知名历史古都。
25日(周一)上午,会议开幕式由北京大学焦宁教授主持,陕西师范大学副校长高子伟教授致欢迎词。出席开幕式的国内外著名学者代表有:中国科学院复旦大学麻生明院士、香港大学支志明院士、武汉大学雷爱文教授、北京大学焦宁教授、罗马大学Valeria Contes教授、耶鲁大学James M. Mayer教授、约翰霍普金斯大学David P. Goldberg教授、利物浦大学Jianliang Xiao教授、里昂催化研究所Alexander Sorokin教授、东京大学Shū Kobayashi教授、大阪大学Shinobu Itoh教授、吉罗纳大学Miguel Costas教授、波列斯科夫催化研究所Oxana A. Kholdeeva教授等。
这次ADHOC国际盛会的组织准备工作非常到位,日程安排很充实(第十三届氧气活化和均相氧化催化国际研讨会(ADHOC) 会议安排)
29日(周五)上午,研讨会闭幕式由武汉大学雷爱文教授主持致闭幕词,宣布海报奖获得者名单并由Junichi Yoshida和Matthias Beller两位教授为获奖者颁发证书 。最后,全体参会人员对来自陕西师范大学的会务组人员的辛勤服务工作表示了诚挚的感谢,本次研讨会也在热烈掌声中圆满落下帷幕。
本次研讨会为期六天,各国知名学者围绕着氧气活化和均相氧化催化这一主题,就催化氧化或过氧化氢、酶氧化、氧气活化机理以及氧化工业应用等方面的最新研究进展进行深入的探讨。这次研讨会,大家共同探讨该领域发展的新思路、新趋势、创新协作,为日后共同创建合作共赢的高端研究平台提供了很好地契机。
2021年第14届ADHOC研讨会,欧洲见!!!
概要
Fetizon试剂其实就是Celite为载体的碳酸银(I)、该试剂是一种十分温和的氧化试剂。特别是可以选择性的把半缩醛氧化成内酯,效果十分好。而该氧化反应也被称为Fetizon氧化。
基本文献
- Fetizon, M.; Golfier, M. C.R. Acad. Sci. Ser. C 1968, 267, 900.
- Tronchet, J. M. J.; Tronchet, J.; Birkhauser, A. Helv. Chim. Acta 1970, 53, 1489. DOI:10.1002/hlca.19700530632
- Fetizon, V.; Fetizon, M.; Golfier, M. J. Org. Chem.1971, 36, 1339. DOI: 10.1021/jo00809a004
- Fetizon, M.; Golfier, M.; Morgues, M. Tetrahedron Lett.1972, 4445. doi:10.1016/S0040-4039(01)94337-0
- Fetizon, M.; Golfier, M.; Milcent, R.; Papadakis, I. Tetrahedron 1975, 31, 165. doi:10.1016/0040-4020(75)85012-5
- Fetizon, M.; Golfier, M.; Louis, J.-M.Tetrahedron 1975, 31, 171. doi:10.1016/0040-4020(75)85013-7
- McKillop, A.; Young, D. W. Synthesis 1979, 401. DOI: 10.1055/s-1979-28699
反应机理
反应实例
除了选择性氧化半缩醛以外,如下图所示,底物中含有二级醇与三级醇,Fetizon试剂可以选择性的氧化位组小的二级醇
实验步骤
实验技巧
参考文献
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
- 概要
糠醇在氧化条件下、合成二氢吡喃环的方法。在该反应中,Br2、NBS、mCPBA经常被用作氧化剂。该反应最终得到呋喃环的1,4-二酮等价体。
- 基本文献
- Achmatowicz, O.; Bukowski, P.; Szechner, B.; Zwierzchowska, Z.; Zamojski, A. Tetrahedron 1971,27, 1973. doi:10.1016/S0040-4020(01)98229-8
<review>
- Ciufolini, M. A.; Hermann, C. Y. W.; Dong, Q.; Shimizu, T.; Swaminathan, S.; Xi, N. Synlett 1998, 105. DOI: 10.1055/s-1998-1584
- Harris, J. M.; Li, M.; Scott, J. G.; O’Doherty, G. A. in Strategy and Tactics in Natural Product Synthesis, ed. M. Harmata, Elsevier, London, 2004, 5, 221–253.
- Merino, P. Curr. Org. Chem. 2007, 11, 1076.
- 开发历史
1971年波兰的化学家Achmatowicz Jr.等人利用液溴作为氧化剂氧化糠醇首次成功合成了单糖类化合物。所以该反应以及类似反应以开发者的名字被命名为Achmatowicz反应。
- 反应机理
- 反应实例
D-Swainsonine的合成[1]
- 实验步骤
- 实验技巧
- 参考文献
- 概要
2-碘酰基苯甲酸(2-Iodoxybenzoic Acid; IBX)可以在温和的条件下做多种氧化反应。2-碘酰基苯甲酸通过邻碘苯甲酸和过一硫酸氢钾简单制备得到(参考戴斯-马丁氧化)。由于IBX在DMSO以外的有机溶剂里溶解性都不好,长久以来没有作为有机反应试剂普及使用。近年来Nicolaou等人投入大量精力,开发出一些值得期待的反应成果。
- 基本文献
・Frigero, M.; Santagostino, M. Tetrahedron Lett. 1994, 35, 8019. doi:10.1016/0040-4039(94)80038-3
・De Munari, S.; Frigero, M.; Santagostino, M. J. Org. Chem. 1996, 61, 9272. DOI:10.1021/jo961044m
・Moore, J. D.; Finney, S. N. Org. Lett. 2002, 4, 3001. DOI: 10.1021/ol026427n
・Nicolaou, K. C.; Zhong, Y. L.; Baran, P. S. J. Am. Chem. Soc. 2000, 122, 7596. DOI:10.1021/ja001825b
・Nicolaou, K. C.; Montagnon, T.; Baran, P. S.; Zhong, Y.-L. J. Am. Chem. Soc. 2002, 124, 2245. doi:10.1021/ja012127+
・Nicolaou, K. C.; Mathison, C. J. N.; Montagnon, T. Angew. Chem. Int. Ed. 2003, 42, 4077. doi:10.1002/anie.200352076
- 反应机理
已知体系中水的存在不利于反应的进行,如下所示的通过配体交换的反应机理被主张。(参照:J. Am. Chem. Soc. 2005, 127, 14146.)
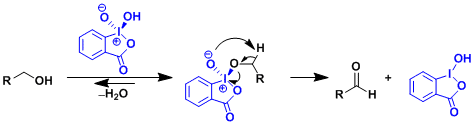
- 反应实例
戴斯-马丁试剂能使1,2-二醇离解,本反应使用IBX在醇无需离解的情况下就能进行。[1]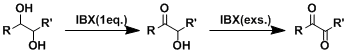 α,β-不饱和酮也可以做为反应底物。[2]
α,β-不饱和酮也可以做为反应底物。[2] 苄基位的亚甲基能被氧化成羰基。[3]
苄基位的亚甲基能被氧化成羰基。[3] 烷基胺能被氧化成亚胺。[4]
烷基胺能被氧化成亚胺。[4]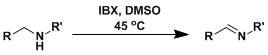 NHS做添加剂的条件下,氧化能到达羧酸。[5a]官能团适用范围较广。过一硫酸氢钾做重复氧化剂并加热[5b]的情况下,只需要加入催化量的IBX 。
NHS做添加剂的条件下,氧化能到达羧酸。[5a]官能团适用范围较广。过一硫酸氢钾做重复氧化剂并加热[5b]的情况下,只需要加入催化量的IBX 。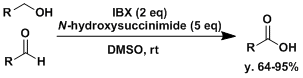
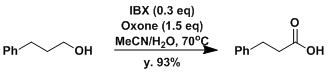 同时有伯醇仲醇的情况下,可以实现只有仲醇被选择性氧化。[6]
同时有伯醇仲醇的情况下,可以实现只有仲醇被选择性氧化。[6]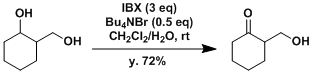 用2-碘苯磺酸作为高活性的氧化催化剂。体系中生成IBX的磺酸。[7]
用2-碘苯磺酸作为高活性的氧化催化剂。体系中生成IBX的磺酸。[7]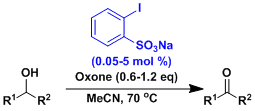 酰胺能够少去一个碳,变成腈。[8]
酰胺能够少去一个碳,变成腈。[8]
- 实验步骤
- 实验技巧
有人提出IBX中的碘处于高价态,有爆炸的可能。做大量反应的时候,及取用IBX都需要特别注意。
- 参考文献
[6] Kuhakarn, C.; Kittigowittana, K.; Pohmakotr, M.; Reutrakul, V. Tetrahedron 2005, 61, 8995. DOI: 10.1016/j.tet.2005.07.051
[7] Uyanik, M.; Akakura, M.; Ishihara, K. J. Am. Chem. Soc. 2009, 131, 251. DOI:10.1021/ja807110n
[8] Bhalarao, D. S; Mahajan, U. S.; Chaudhari, K. H.; Akamanchi, K. G. J. Org. Chem. 2007, 72, 662. DOI: 10.1021/jo0619074
[9] Plumb, J. B.; Harper, D. J. C&EN News 1990, July 16, 3.
- 概要
反应将酮转化为对应的烯醇硅醚,接着在醋酸钯的催化下,得到α,β-不饱和羰基化合物。由于反应需要摩尔当量的醋酸钯催化剂这一不足点,为了减少催化剂用量,反应被进行各种改良。例如,DMSO溶剂中,用氧气将钯再次氧化从而达到催化循环(拉洛克改良),或用二价铜代替氧气做氧化剂,还有一种方法是以碳酸二丙烯基酯做氧化剂(辻改良)。
- 基本文献
・Ito, Y.; Hirao, T.; Saegusa, T. J. Org. Chem. 1978, 43, 1011. doi:10.1021/jo00399a052
・Larock Modification: Larock, R. C.; Hightower, T. R.; Kraus, G. A.; Hahn, P.; Zheng, D. A.Tetrahedron Lett. 1995, 36, 2423. doi:10.1016/0040-4039(95)00306-W
・Tsuji Modification: Shimizu, I.; Minami, I..; Tsuji, J. Tetrahedron Lett. 1983, 24, 1797. doi:10.1016/S0040-4039(00)81773-6
- 反应机理

- 反应实例
Norzoanthamine的合成[1]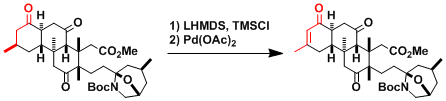
- 实验步骤
- 实验技巧
- 参考文献
- 概要
四甲基哌啶氧化物(TEMPO)是市售的非常稳定的有机自由基化合物。在有机合成中可选择性的氧化伯醇到醛。实验中, TEMPO和做共氧化剂的次氯酸钠或PhI(OAc)2一起使用。体系中共存的仲醇不会被氧化,可以实现选择性氧化伯醇。
- 基本文献
・Lebelev, O. L.; Kazarnovskii, S. N. Zhur. Obshch. Khim. 1960, 30, 1631.
・de Nooy, A. E. J.; Besemer, A. C.; van Bekkum, H. Synthesis 1996, 1153. DOI: 10.1055/s-1996-4369
- 反应机理
TEMPO被氧化后产生的 N-oxoammonium(N-氧合铵离子)具有氧化活性。
- 反应实例
Kuehneromycin A的合成[1]
丙烯醇的活性非常高。即使底物中含硫、硒原子等(易被氧化的)基团,也能选择性氧化醇羟基 [2]
在二相体系反应,能进行伯醇/仲醇的选择性氧化[3]
反应剂AZADO的立体位阻比TEMPO要小并反应性高。所以AZADO可用于立体位阻大的醇化合物 [4]
- 实验步骤
用PhI(OAc)2做共氧化剂和TEMPO一起使用 [5]
往250mL的圆底烧瓶里加入乙腈(28 mL)、(Z)-3,7-dimethyl-2,6-octadien-1-ol (nerol) (5.70 mL, 32.5 mmol)、pH7.0缓冲水溶液(8 mL)、TEMPO (490 mg, 3.24 mmol)、二醋酸碘苯 PhI(OAc)2 (11.49 g, 35.71 mmol)。等原料消失为止保持0℃持续搅拌。用乙醚(100 mL)稀释后、再用硫代硫酸钠水溶液(2×50mL)洗涤。之后把水相用乙醚洗三次后(3×35mL)、把有机相用盐水涮洗(40mL)。放进无水硫酸钠干燥所得有机液体。过滤后、用蒸发器(35℃, 70 mmHg)浓缩。把得到的粗产品用柱层析(乙醚/己烷=1/9)分离后、得到油状目标产物(4.30-4.39 g, 収率87-89%)
- 实验技巧
- 参考文献
1] Jauch, J. Angew. Chem., Int. Ed. 2000, 39, 2764. [abstract]
[2] De Mico, A.; Margarita, R.; Parlanti, L.; Vescovi, A.; Piancatelli, G. J. Org. Chem. 1997, 62, 6974. DOI: 10.1021/jo971046m
[3] Einhorn, J.; Einhorn, C.; Ratajczak, F.; Pierre, J.-L. J. Org. Chem. 1996, 61, 7452. DOI:10.1021/jo9609790
[4] Shibuya, M.; Tomizawa, M.; Suzuki, I.; Iwabuchi, Y. J. Am. Chem. Soc. 2006, 128, 8412. DOI:10.1021/ja0620336
[5] Piancatelli,G.; Leonelli, F. Org. Synth. 2006, 83, 18. [PDF]
- 相关书籍
- 相关链接
・TEMPO (Wikipedia)
・OXIDATION (A. Myers’ group: PDF)
- 概要
用二甲亚砜(DMSO)-乙二酰氯(草酰氯)体系对醇的氧化称为斯文氧化。
DCC(Pfitzner-Moffatt氧化)、TFAA(Swern变换)、无水醋酸(Albright-Goldmannyang氧化)、SO3-吡啶(Parrikh-Doering氧化)中都用到DMSO作为活化试剂,但与乙二酰氯的氧化体系副反应较少。最初用TFAA的方法活性非常高,但副反应也较多。
反应后试剂产生的副产物沸点低,容易除去,常用于大量合成醛,但是,反应会生成化学当量的二甲硫醚,有恶臭的气味。
- 基本文献
・Huang, S.-L.; Omura, K.; Swern, D. J. Org. Chem. 1976, 41, 3329. DOI: 10.1021/jo00882a030
・Mancuso, A. J.; Huang, S.-L.; Swern, D. J. Org. Chem. 1978, 43, 2489. doi:10.1021/jo00406a041
・Omura, K.; Swern, D. Tetrahedron 1978, 34, 1651. doi:10.1016/0040-4020(78)80197-5
・Review: Mancuso, A. J.; Swern, D. Synthesis 1981, 165. doi:10.1055/s-1981-29377
・Marx, M.; Tidwell, T. T. J. Org. Chem. 1984, 49, 788. DOI: 10.1021/jo00179a009
・Review: Tidwell, T. T. Org. React. 1990, 39, 297.
・Review: Tidwell, T. T. Synthesis 1990, 857. doi:10.1055/s-1990-27036
・Review: Lee, T. V. Comprehensive Organic Synthesis 1991, 7, 291.
- 反应机理
DMSO与乙二酰氯反应,生成氯锍盐中间体作为氧化活性剂,这一试剂对水敏感,且温度超过-60°C迅速分解,所以,此反应必须在低温(-78°C)及无水条件下进行。另外,有毒气体CO和恶臭气味的Me2S的生成,反应须在通风橱里进行,这样,此反应的缺点是其操作较复杂。
副反应中最常见的是甲硫甲基醚化(MTM化)。温度高时反应中的氯锍盐发生Pummerer异构的产物与醇反应,生成MTM保护产物。
- 反应实例
温和的条件下进行,可用于不稳定的醛的合成。是多数氧化反应中最常用的反应。以下是具体合成(+)-Thiazinotrienomycin E的实例[1]
TFAA条件的实例[2]
- 实验步骤
乙二酰氯(2.1 mL, 24 mmol)的二氯甲烷溶液(30 mL) 冷却到-78°C ,滴加DMSO(3.3 mL, 21 mmol)的二氯甲烷溶液(32 mL)。 迅速有大量气体产生,5分钟后加入醇 (4.0 g, 20 mmol)的二氯甲烷(26 mL),-78°C搅拌15分钟。然后一次性加入三乙胺(14 .0 mL, 100 mmol), -78 °C下搅拌10分钟后,缓缓升至室温,用二氯甲烷稀释后,饱和氯化铵水溶液、食盐水(2次)洗涤,无水硫酸镁干燥,过滤后溶媒在通风橱内减压蒸去(有恶臭气味),flash柱色谱(石油醚/乙酸乙酯 = 9:1)纯化精制得到目标产物醛为无色液体(3.88 g,96%)。[3]
- 实验技巧
- 通常用二氯甲烷做溶剂,此外THF、乙醚也能使用
- 除非有特别要求,一般都是以底物:乙二酰氯:DMSO:三乙胺 = 1:2:3:6的摩尔比作为标准配比来进行反应。
- DMSO产生的恶臭气味,全部操作都要在通风橱内,使用后的玻璃仪器用次氯酸水溶液(bleach)浸泡,能除去恶臭的气味。
- 参考文献
[2] Braish, T. F.; Saddler, J. C.; Fuchs, P. L. J. Org. Chem. 1988, 53, 3647. DOI: 10.1021/jo00251a001
[3] Taillier, C.; Gille, B.; Bellosta, V.; Cossy, J. J. Org. Chem. 2005, 70, 2097. DOI: 10.1021/jo048115z
- 相关书籍
























